Egy új vizsgálat szerint az agyban lévő immunsejtek működésének befolyásolása megakadályozhatja a kognitív hanyatlás kialakulását.
Az öregedés és főleg az öregedés elkerülése mindig foglalkoztatta az embereket. Már Hérodotosz írásaiban is megjelent a fiatalság forrása, egy varázslatos forrás, melynek vize visszafiatalít bárkit, aki iszik belőle vagy megfürdik benne. Ilyen forrást persze soha nem talált senki, ám azóta is nagy erőkkel dolgoznak rajta az emberek, hogy visszafordítsák az öregedés kellemetlennek tartott következményeit. Az egyik ilyen következmény a kognitív hanyatlás, vagyis az értelmi képességek nagymértékű leromlása. Egy új vizsgálat szerint az agy őrei, a mikrogliák működésének megváltoztatása csökkenti a gyulladást és a neurodegenerációt az idős egerek agyában, ez pedig javítja az idegrendszeri funkciókat.

Kognitív hanyatlás
A kognitív képességek leromlása normális része az öregedésnek. Ezek a képességek 30 éves kor környékén tetőznek, majd lassan elkezdenek leromlani, ami gyakran alig észrevehető. Általában lelassul a gondolkodás, nehezebb fenntartani a figyelmet, előfordulhatnak kisebb problémák az emlékezéssel is. Enyhe kognitív zavarról akkor beszélnek a szakértők, amikor ezek a problémák jóval hangsúlyosabbak és gyorsabban jelentkeznek. Ugyan az enyhe kognitív zavar okai egyelőre nem teljesen világosak, az esetek egy jelentős részében ez az állapot a súlyosabb demencia előjele. A demencia esetében a kognitív hanyatlás olyan mértékű, hogy önellátásra képtelenné válhat a beteg. A demencia leggyakoribb oka az Alzheimer-kór, amely egyre nagyobb probléma a nyugati társadalmakban.
Gyulladás és neurodegeneráció az idősödés során
Az idősödés és a halál a fajfenntartás szempontjából előnyös folyamat. Az élőlények újabb és újabb generációkat hoznak létre, melyek között jó eséllyel lesznek, akik könnyebben túlélnek akár változó körülmények között is, így végső soron a faj is fennmarad, noha az egyedi életeknek vége szakad. Úgy tűnik, hogy az öregedés okozta biológiai hanyatlás hátterében a sejteket érő sérülések felhalmozódása áll. Ezek a sérülések önmagukban is károsan hatnak bizonyos életfolyamatokra, illetve olyan immunfolyamatokat indítanak be, melyek fiatalabb korban csak fertőzések hatására mennek végbe. A sérült sejtek olyan molekulákat szabadítanak fel, amelyek serkentik a gyulladást, illetve a sejtek közötti (extracelluláris) mátrix degradációját (ez a sejtek között található makromolekulák rendszere, amely fizikai és biokémiai támogatást nyújt a sejteknek).
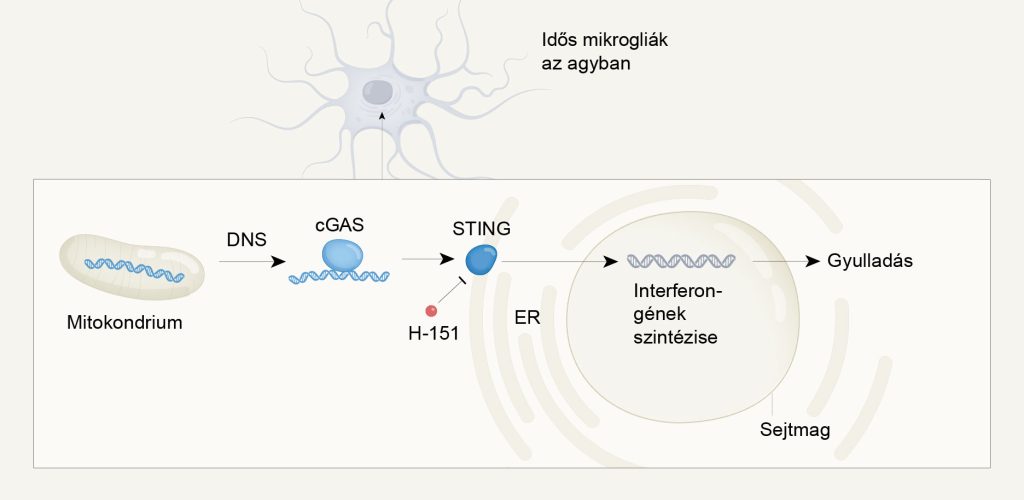
Korábban kiderült, hogy a gyulladást egy olyan jelátviteli útvonal (cGAS-STING – ciklikus GMP-AMP szintáz – interferon genezis stimulátora) váltja ki, mely a sejttestben lévő DNS hatására lép működésbe. Az egészséges sejtekben a DNS csak a sejtmagban és a mitokondriumokban fordul elő, jelenléte a sejttestben valamilyen sérülésre utal. A jelátviteli útvonal aktivációja az interferonoknak nevezett molekulák felszabadulását idézi elő, amelyek beindítják a gyulladást.
cGAS-STING
A ciklikus GMP-AMP szintáz – interferon genezis stimulátora (cGAS-STING) jelátviteli útvonalat a 2010-es években fedezte fel egy kínai kutatócsoport. A sejttestben lévő DNS kötésének hatására a GMP-AMP szintáz ciklikus GMP-AMP molekulát hoz létre, amely aktiválja az interferon genezis stimulátorát (STING). Ez a fehérje aztán további fehérjék (IRF3 és TBK1) közbeiktatásával interferonok szintézisét idézi elő a sejtmagban. Az interferonok megváltoztatják a sérült sejt és a környező sejtek működését, ezzel gátolják a vírusok terjedését.
A mikrogliákkal van a baj
Egy európai kutatócsoport azt vizsgálta, hogy milyen sejtekben aktiválódik az említett jelátviteli útvonal. A kutatók először sejttenyészetekben győződtek meg róla, hogy a H-151 nevű vegyület gátolja a jelátviteli útvonalat. Ezután idős (26 hónapos) egereket használtak és kimutatták, hogy a H-151 hatására egy sor idegrendszeri funkció jobban megőrződik. Lemérték például az egerek szorításának erejét és azt is, hogy mennyi időn át képesek fennmaradni egy ferde futószalagon. Ezek mellett a Morris-féle vízi labirintuson és a félelmi kondicionáláson is jobban teljesítettek az állatok, melyek a tanulást mérő feladatok.
Morris-féle vízi labirintus
A Morris-féle vízi labirintus egy klasszikus viselkedéses teszt. A lényege, hogy átlátszatlan vízzel teli tartályba helyeznek egy patkányt vagy egeret, amelyek azonnal elkezdik felderíteni. A víz alatt egy platform helyezkedik el, amelyre ki tudnak úszni. A többszöri visszahelyezés során az állatok egyre gyorsabban találják meg a víz alatti felületet, az ehhez szükséges idő jelzi a tanulás hatékonyságát.
Félelmi kondicionálás
A félelmi kondicionálás során általában egy olyan ketrecbe helyezik a kísérleti állatokat, amelynek az aljába áramot lehet vezetni. A kellemetlen áramütés hatására a kísérleti állatok egy idő után megdermednek, mikor a ketrecbe helyezik őket. A dermedési reakció időbeli lefolyása utal a tanulás hatékonyságára.
Az idegrendszeri funkcióknál tapasztalt hatás és az a tény, hogy a H-151 átjut a vér-agy gáton, arra utaltak, hogy az agyban is aktiválódik a gyulladást előidéző jelátviteli útvonal, így a kutatók mintákat vettek az idős egerek agyából és ezeken folytatták a vizsgálódást. A H-151 kezelésen átesett állatoknál jóval kevesebb volt a gyulladásra utaló molekulák mennyisége, illetve nagyobb volt az idegsejtek sűrűsége és az idegsejtkapcsolatok száma is. A kutatók megvizsgálták, hogy mely agyi sejteknél változott meg számottevően a génkifejeződés a kezelés hatására, hiszen ez utal a sejtek működési sajátosságaira. Kiderült, hogy a mikrogliáknál van ilyen változás.
A mikrogliák az idegszövetben található gliasejtek csoportjába tartoznak és az agyi sejtek nagyjából 10%-át teszik ki. Legfőbb feladatuk az idegrendszer védelme, bekebelezik az esetleges behatolókat és eltakarítanak minden szükségtelen anyagot. További vizsgálatoknak köszönhetően az is kiderült, hogy az idős egerek mikrogliáiban található mitokondriumokban elváltozik a DNS szerkezete. A mitokondriumok saját DNS-sel rendelkeznek és mivel folyamatosan energiahordozó molekulákat (adenozin-trifoszfát – ATP) hoznak létre, ki vannak téve olyan kémiai hatásoknak, melyek roncsolhatják az őket felépítő szerves molekulákat. Úgy tűnik, hogy a DNS is erre a sorsra juthat és emiatt kikerülhet a sejttestbe, ahol aktiválja a cGAS-STING jelátviteli útvonalat. Ez interferonok felszabadulását eredményezi, melyek gyulladást idéznek elő. A gyulladás roncsolja az idegszövetet, egyes neuronok elpusztulhatnak, ez pedig végső soron kognitív hanyatláshoz vezet.
Mindezek alapján felmerülhet, hogy a H-151 használható lenne a kognitív hanyatlás megakadályozására, azonban ennek megerősítéséhez még további kísérletekre lesz szükség. A H-151 által gátolt jelátviteli útvonalnak ugyanis fontos szerepe van a fertőzések elleni védekezésben és így elképzelhető, hogy visszafelé sülne el a beavatkozás. Azt is fontos szem előtt tartani, hogy az egerek nagyjából 2 éves élettartama jóval elmarad az emberéhez képest, így nem teljesen biztos, hogy azonos folyamatok eredményezik a kognitív hanyatlást embereknél. Az emberi mikrogliák akár 20 éven keresztül is tevékenykedhetnek, tízszer annyit élnek, mint a kísérletben használt egerek. Mindenesetre az új eredmény utat nyit az öregedés egyik legrettegettebb következményének enyhítése irányába.
Ez a cikkem az Élet és Tudomány Agyi aktualitások rovatában jelent meg.
Források
How the cGAS–STING system links inflammation and cognitive decline (nature.com)
cGAS–STING drives ageing-related inflammation and neurodegeneration | Nature


